PHOTO
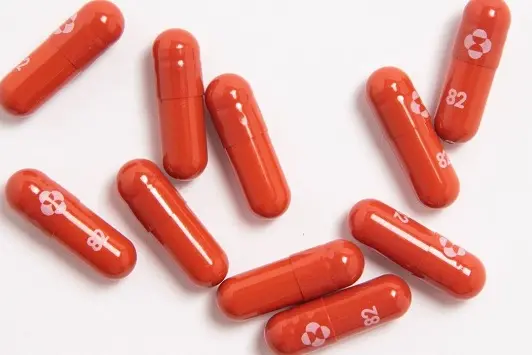
Primo via libera alla pillola anti-Covid della Merck . L'agenzia britannica del farmaco ha infatti autorizzato l'impiego del farmaco denominato "molnupiravir", considerato un importante nuovo strumento per combattere la pandemia. Lo hanno annunciato l'americana Merck e la connazionale Ridgeback Biotherapeutics.
"La Mhra (Agenzia del farmaco Uk) - comunicano le aziende in una nota - ha autorizzato il farmaco antivirale per il trattamento di Covid-19 da lieve a moderato, negli adulti positivi a Sars-CoV-2 che presentano almeno un fattore di rischio per lo sviluppo di malattia grave".
"Molnupiravir, che è ancora al vaglio degli altri enti regolatori internazionali, fra cui l'americana Fda e l'euroepa Ema, nei test clinici ha dimezzato il rischio di ricovero in ospedale o di decesso per le persone colpite dal Covid in forma lieve o moderata".
Molnupiravir, somministrato alla dose di 800 milligrammi per due volte al giorno in pazienti Covid adulti non ospedalizzati e non vaccinati, con infezione da lieve a moderata confermata in laboratorio, insorgenza dei sintomi entro i 5 giorni precedenti l'inserimento nel trial e almeno un fattore di rischio associato a prognosi negativa (per esempio malattie cardiache o diabete), ha dimezzato la probabilità di ricovero e morte.
"Come terapia orale, molnupiravir offre un'importante opportunità aggiuntiva ai vaccini e ai medicinali impiegati finora per contrastare la pandemia di Covid-19", sottolinea Dean Y. Li, vicepresidente esecutivo e presidente di Merck Research Laboratories, ringraziando "i ricercatori, i pazienti e le loro famiglie per il contributo allo studio Move-Out che ha reso possibile questa autorizzazione".
Anche l'Ema ha avviato la procedura di revisione continua per la pillola anti Covid molnupiravir. I dati suggeriscono che la pillola può ridurre la capacità del coronavirus di replicarsi. La revisione dell'Agenzia continuerà "fino a quando non saranno disponibili prove sufficienti per consentire all'azienda di presentare una domanda formale di autorizzazione all'immissione in commercio". L'Agenzia valuterà la conformità di molnupiravir agli standard Ue in materia di efficacia, sicurezza e qualità.